Periyodik Sistem

Periyodik Sistem konusu 8. Sınıf 4. Ünitenin birinci konusudur.
F.8.4.1. Periyodik Sistem
Önerilen Süre: 4 ders saati
Konu / Kavramlar: Grup, periyot, periyodik sistemin sınıflandırılması
Kazanımlar
F.8.4.1.1. Periyodik sistemde, grup ve periyotların nasıl oluşturulduğunu açıklar.
F.8.4.1.2. Elementleri periyodik tablo üzerinde metal, yarımetal ve ametal olarak sınıflandırır.
Periyodik Sistem
- Elementler benzer ve farklı özelliklerine göre sınıflandırılmıştır.
- Doğada bulunan elementlerin daha kolay incelenebilmesi, arandığında daha kolay bulunabilmesi için belirli özelliklerine göre sınıflandırılmıştır.
- Elementlerin sınıflandırılması sonucunda periyodik sistem oluşmuştur.
- Periyodik sistem oluşturulduktan sonra yeni bulunan elementlerin hangi özellik gösterebileceği tahmin edilebilmiştir.
A-) Periyodik Sistemin Tarihçesi
1.Johann Döbereiner (Yohan Döbereynar)
Elementlerin sınıflandırılması ile ilgili ilk çalışmayı yapmıştır.
Benzer özellik gösteren elementleri üçlü gruplar oluşturmuştur.
Lityum, sodyum, potasyum elementlerinin benzer özellik gösterir.
2. Alexandre Beguyer de Chancourtois (Aleksandır Beguye dö Şankurtua)
Benzer fiziksel özellikleri gösteren elementleri dikey gelecek şekilde sarmal olarak sıralamıştır.
Elementlerin dışında bazı iyonlara da yer vermiştir.
3. John Newlands (Con Nivlends)
O zamana kadar bilinen 62 elementi atom ağırlığına göre sıralamıştır. İlk 8 elementten sonraki elementlerin fiziksel ve kimyasal özelliklerinin tekrarladığını fark etmiştir. (Oktav kanunu)
4. Lothar Meyer (Lotar Meyer)
Mendeleyev ile aynı zamanda elementleri benzer biçimde sıralamıştır.
Elementleri sıralarken fiziksel özelliklerine göre sıralamıştır.
5. Dimitri İvanovic Mendeleyev (Dimitri İvanoviç Mendeleyev)
Elementleri kütle numaralarına (atom ağırlıklarına) göre sıralamıştır.
Ancak bazı elementlerin yeri bulunması gereken yerden farklı olmuştur.
Periyodik sistemde boşluklar bırakarak daha bulunmamış elementleri tahmin etmiştir.
Periyodik sistemin babası olarak bilinir.
6. Henry Moseley (Henri Mozeli)
Günümüzdeki periyodik tablonun temelini atmıştır. Elementleri atom numaralarına (proton sayısına) göre sıralamıştır.
7. Gleen Seaborg (Gılen Siborg)
Periyodik tabloya en altta iki satır ekleyerek (Lantanit ve Aktinit), en son halini almasını sağladı.
B-) Periyodik Sistem
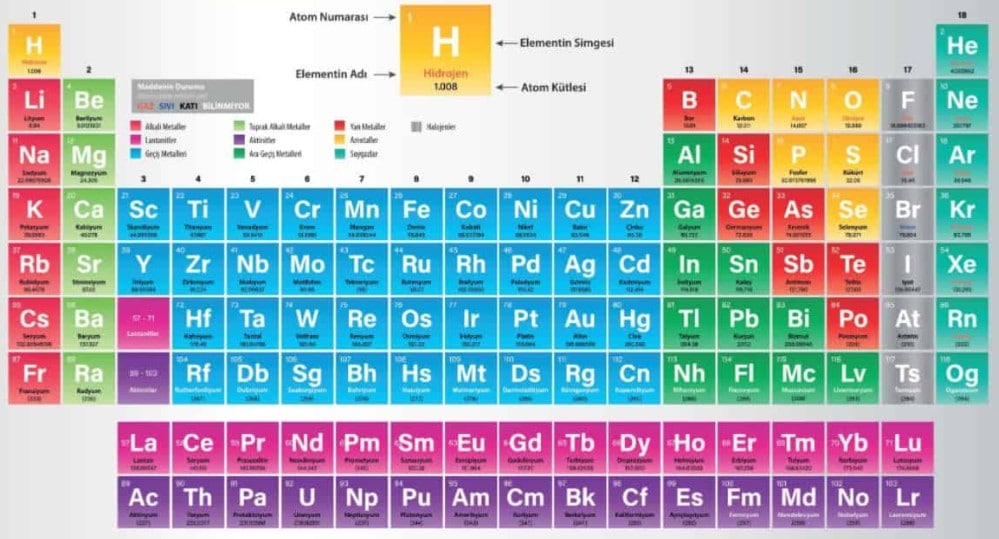
Elementlerin artan atom numaralarına göre sıralandıklarında oluşan tabloya “Periyodik Sistem” denir.
• Elementlerin fiziksel ve kimyasal özellikleri guruplarda benzer özellik gösterir.
• Periyodik sistemde elementlerin adı, sembolü, atom numarası gibi birçok özellik yer alır.
• Elementler atom numaralarına göre sıralandıklarında bazı özelliklerin periyotlar halinde tekrar etmektedir. Periyodik tabloda benzer özellikler alt alta sıralıdır.
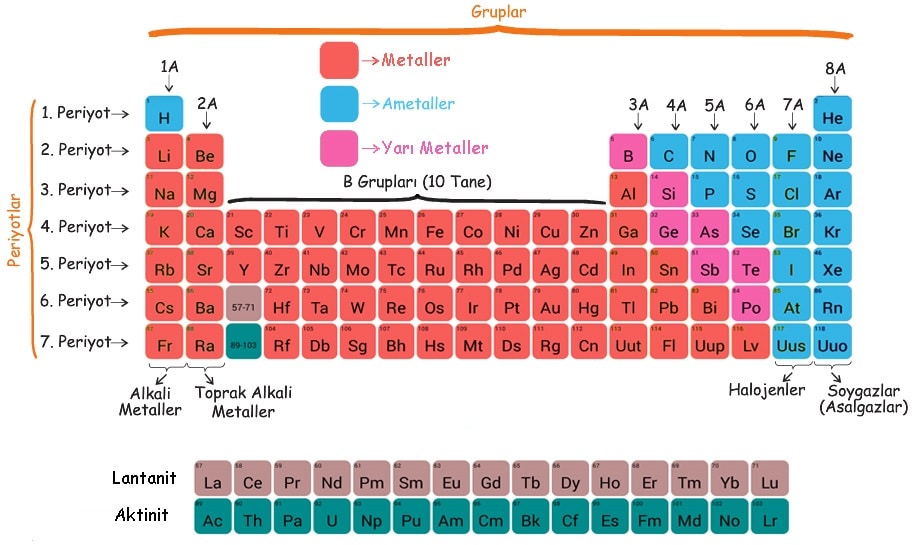
Periyot
Yatay sıralara periyot denir. 7 adet periyot vardır.
Grup
Dikey sütunlara grup denir. 18 adet grup vardır.
Periyodik Sistemde Grupların Özellikleri
Aynı grupta bulunan elementlerin kimyasal özellikleri (sertlik, parlaklık, iletkenlik, reaksiyona girme isteği vb.) genellikle benzerdir.
Aynı grupta bulunan elementlerin yukarıdan aşağıya doğru gittikçe;
• Atom numarası (Proton sayısı) artar.
• Kütle numarası artar.
• Metalik özellik artar, ametalik özellik azalır.
• Son katmanında elektron sayıları değişmez.
• Atom hacmi (çapı) artar.
• Katman sayısı (Periyot sayısı) artar.
• Elektron verme isteği artar.
Bazı grupların özel isimleri vardır.
• 1A grubu Alkali metaller
• 2A grubu Toprak alkali metaller
• 7A grubu Halojenler
• 8A grubu Soy (Asal) gazlar
Periyodik Cetvelde Periyotların Özellikleri
Aynı periyotlarda soldan sağa gittikçe;
• Atom numarası (Proton sayısı) artar.
• Kütle numarası artar.
• Katman sayısı (Periyot sayısı) değişmez.
• Atom hacmi (çapı) azalır.
• Değerlik elektron sayısı (son yörüngedeki elektron sayısı) artar.
• Metalik özellik azalır, ametalik özellik artar.
• Elektron alma isteği artar.
Elementlerin Periyodik Sistemde Yerlerinin Bulunması
Bir elementi periyodik sistemdeki yeri nötr durumdaki elektron dağılımına göre yapılır. Elektron dağılımında;
Katman sayısı = Periyot Numarası
Son Katmandaki elektron sayısı = Grup Numarasını verir.
Elektron dağılımı
1. Katman 2 elektron
2. Katman 8 elektron
3. Katman 8 elektron alabilir.
Örnek: 13 atom numaralı alüminyumun elektron dağılımını ve periyodik sistemdeki yerini bulalım.
Elektron dağılımı
Al -> 13: 2) 8) 3)
3. Periyot (3 katman olduğu için)
3A gurubu (Son katmanda 3 elektron olduğu için)
Atomun kimliğini atomdaki proton sayısı belirler. Farklı elementlerin de proton sayısı birbirinden farklıdır.
Elementlerin sayısı 118 civarındadır. Bunlardan 90 tanesi doğada bulunmaktadır.
Bilim insanları elementleri benzer özelliklerine göre sınıflandırmıştır.
Elementler sınıflandırılarak kullanımı ve anlaşılması kolaylaşır.
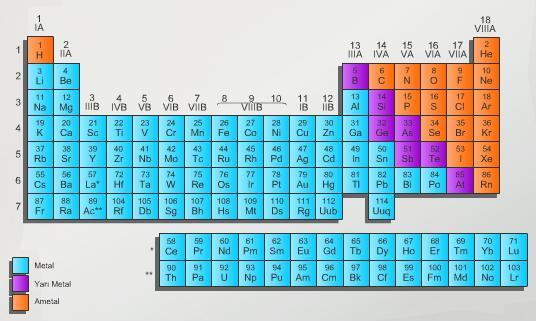
C-) Elementlerin Sınıflandırılması
Elementler; metal, ametal ve yarı metal olmak üzere üç gruba ayrılmaktadır.
A-) Metallerin Genel Özellikleri
• Tel ve levha haline getirilebilir.
• Isı ve elektriği iyi iletir.
• Parlaktır.
• Oda koşullarında katıdır.(Cıva hariç)
• Atomik yapıdadır
• Kendi aralarında bileşik yapmazlar, alaşım oluştururlar.
• Son yörüngelerindeki elektron sayısı (değerlik elektron sayısı) 1,2 veya 3 tür.
• Periyodik sistemin sol tarafında yer alırlar.
İlk 18 element içerisindeki metaller:
Lityum (Li), Berilyum (Be), Sodyum (Na), Magnezyum (Mg), Alüminyum (Al)
A-) Yarı Metallerin Genel Özellikleri
Fiziksel özellikleri bakımından metallere, kimyasal özellikleri bakımından ametallere benzemektedirler. Yarı metaller elektronik devrelerde, merceklerde ve projektörlerde kullanılır.
• Parlak veya mat görünümdedir
• Oda koşullarında katıdır.
• Tel ve levha haline gelebilir.
• Isı ve elektriği ametallerden iyi, metallerden kötü iletir.
• Periyodik sistemde kırık çizgi halinde bulunur.
İlk 18 element içerisindeki yarı metaller:
Bor (B) ve Silisyum (Si)
A-) Ametallerin Genel Özellikleri
• Tel ve levha haline getirilemez.
• Isı ve elektriği iyi iletmez.
• Mattır.
• Oda koşullarında katı, sıvı ve gaz haldedir.
• Molekül yapıdadır.
• Elektron alarak – yüklü (Anyon) oluşturur.
• Son yörüngelerinde 5,6 veya 7 elektron bulundurur.
• Periyodik sistemin sağ tarafında bulunmaktadır.
İlk 18 element içerisindeki ametaller:
Hidrojen (H), Karbon (C), Azot (N), Oksijen (O), Flor (F), Fosfor (P), Kükürt (S), Klor (Cl)
Soygazlar
Soygazlar, ametaller içerisinde yer alan özel bir gruptur.
Soygazların Genel Özellikleri
• Oda şartlarında hepsi gaz halindedir.
• Kararlı yapıya sahiptir, kimyasal reaksiyona girmezler
• Bileşik oluşturmazlar
• Tek atomludur.
• Erime ve kaynama noktaları çok düşüktür.
• Son yörüngelerinde 8 elektron bulundururlar. (Helyum hariç)
• Işığı geçirirler (Saydamdır)
• Isı ve elektriği iletmezler.
• Periyodik sistemin 8A gurubunda bulunurlar.
İlk 18 element içerisindeki soygazlar:
Helyum (He), Neon (Ne) ve Argon (Ar)
Hidrojen: Ametal olması, 1A grubunda metallerin arasında bulunması
Helyum: Son yörüngesinde 2 elektron olması, 2A grubu yerine 8A grubunda olması
Periyodik sistem sorularında bu iki elemente ekstra dikkat etmek gerekir!!
Ayrıca periyodik tablo üzerinde elementlerin sınıflarının yerleri bilinmesi önemlidir. Burada da yarı metallerin yerlerini iyice bilmek yeterli olur. Yarı metallerin altında ve solunda kalan kısım metaller, sağında kalan kısımlar ise ametalleri oluşturur.